研究内容 
はじめに
脳科学の究極の目標は、人間の精神の営みを理解することです。
では、人間の精神の営みのベースは何でしょうか?いろいろあると思いますが、
私たちは、それらの中でも特に重要なものがふたつあると考えています。
ひとつは「意識」です。「意識」は、私たちの現在の研究の対象ではないので、
ここではこれ以上触れません。
もうひとつは、「知識や概念」を形成して持っているということです。
私たちの精神の営みのベースには知識があります。たとえば、私たちが何か考える時、
思考のベースには過去に獲得した知識があり、それを照合しながら新しい事柄を
考えていきます。創造性も同じです。過去の知識がベースになっています。
もし記憶することができなかったり、新しいことを覚えても忘れてしまったりして
知識を形成することができなければ、精神的な営みもできません。
そういう意味で、「記憶」は人間の精神の営みの一番ベースにあるのです。
このように考えてみれば、記憶のメカニズムを明らかにすることは、
精神の営みを解明するための第一歩ということになります。
現在の研究内容
現在は、新しい学術を切り拓く挑戦性のある研究として、科学研究費・特別推進研究の支援を受けて
「アイドリング脳研究」を中心課題として取り組んでいます。
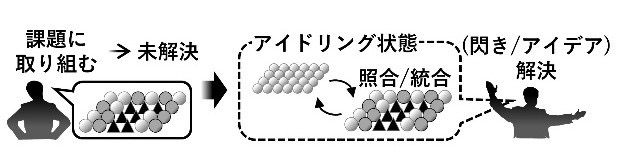
脳は課題遂行中だけでなく睡眠中や休息時にも活動を続けていること、すなわちアイドリング状態であることが明らかになってきました。誰しもが「未解決の課題が睡眠やリラックスのあとなどに突然解決する経験」をしています。
私たちはマウスを用い、学習時に同期活動した脳海馬の数多くのニューロン集団(セルアセンブリ)のうち、引き続く睡眠時に再活動(リプレイ)したものだけが、その後の想起時にも活動することを発見し、特定のセルアセンブリの睡眠時におけるリプレイが記憶の固定化を担っている可能性を見いだしました。
これらのことは、脳のアイドリング活動は、従来考えられていた以上に様々な重要な機能を持っていることを示唆しています。
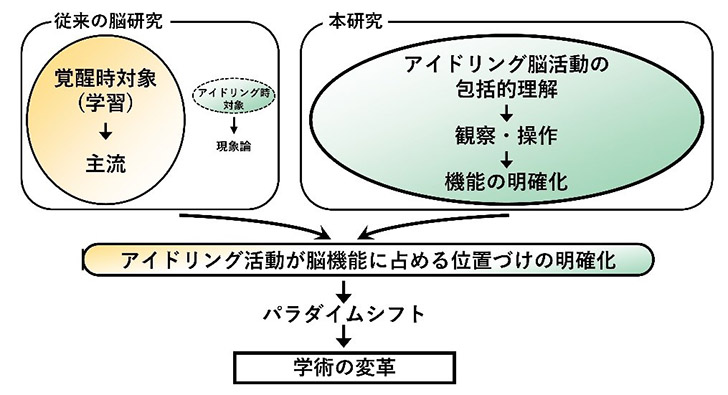
そこで、従来アプローチ不可能であった「アイドリング中の脳活動の種々の機能を明らかにし、脳機能に占めるアイドリング活動の位置づけを明確化し、脳神経研究にパラダイムシフトを導く」ことを目的として研究を進めています。
<脳研究にパラダイムシフトを導き、学術の変革を促す>
従来の記憶研究をはじめとする脳研究は、覚醒時に動物が学習課題に意識を向けている状態にフォーカスして、そのメカニズムを解析するものが主流でした。近年になって睡眠中や休息中など動物が意識を向けていない時の脳活動にも少しずつ注意が向けられてきましたが、いずれも現象論に留まっておりそれらの脳活動がどのような機能を持っているのかは推測の域を出ていません。
このような状況の中で、アイドリング脳研究では現象の包括的な観察に加えて、最先端の技術を駆使してアイドリング中の脳活動を操作することで、それらの活動と情報処理の間を因果関係として明らかにしていきます。
これによって、従来はアプローチされていなかった脳が持つ潜在的な能力を科学的な根拠に基づいて理解することが可能となります。
これまでの研究
2011年~2018年の研究内容
記憶は、学習時に活動した特定の神経細胞集団(セルアセンブリ)という形で脳内に残った物理的な痕跡として保存される。この細胞集団(記憶エングラム細胞集団)が、記憶痕跡である。学習時に同期活動をした神経細胞同士は強いシナプス結合で結ばれるため、何らかのきっかけで一部の神経細胞が活動すると、このエングラム細胞集団全体が活動し、その結果として記憶が想起される。異なる記憶には異なるエングラム細胞集団が対応する(図1)。
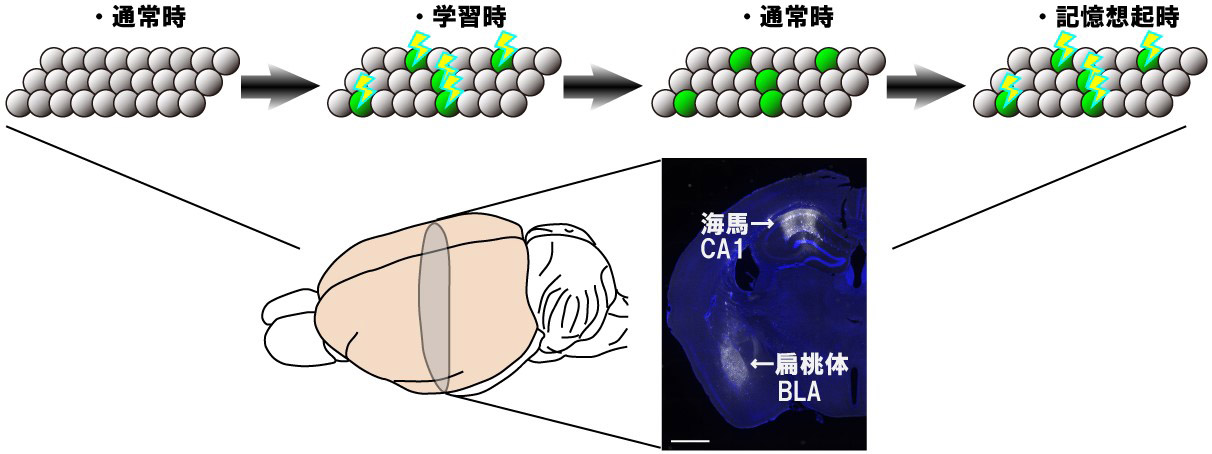
記憶がセルアセンブリとして符号化されて脳内に蓄えられる様子を示す。丸:神経細胞、緑色:学習時に活動した神経細胞、稲妻:活動中であることをあらわす。緑の神経細胞が同時に活動すると、学習時に形成された記憶が想起される。海馬CA1領域はエピソードや場所の情報、扁桃体BLA領域は恐怖情報を司る脳部位。
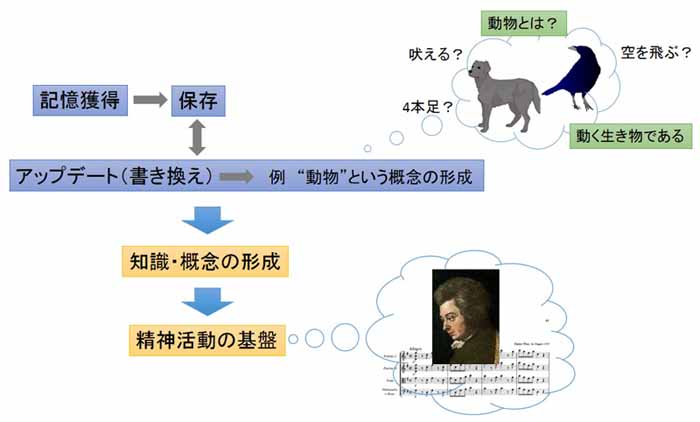
脳が持つダイナミックで柔軟な性質の1つに、異なる記憶同士を連合して新たな意味を持つ記憶を形成する記憶アップデートの能力がある。例えば、「犬のように足が四本で動く生き物は動物」、「カラスのように羽があり空を飛ぶ生き物も動物」といった記憶が関連づけられて、「動物とはこういったものだ」という記憶(知識・概念)が形成される。知識や概念の形成は、異なる経験を通して獲得した記憶を既存の記憶に付け加えていく作業である。すなわち、脳内では個々の記憶同士が相互作用し合うことにより記憶間で新たな連合が生まれ、既存の記憶が更新されていく。このように複数の記憶が連合することで新しい意味を持った記憶が形成されるが、連合のセルアセンブリメカニズムは不明であった。
関連性の弱い記憶同士の不必要な連合や記憶のアイデンティティの喪失は、PTSD(心的外傷後ストレス障害)を始めとする精神疾患や記憶障害を伴う認知症等に密接に関わっていることから、記憶の連合のセルアセンブリメカニズムの解明は医学的な見地からも重要であった。
1. 記憶の連合に関わるセルアセンブリ
2. 行動タグのセルアセンブリメカニズム
3. 2つの記憶の人為的な連合
4. 記憶のアイデンティティを保つ仕組み
5. 脳海馬が記憶力を保つメカニズム
6. まとめ
2010年までの研究
(文中の文献は、PubMedの論文要旨にリンクしています。)
私たちの記憶研究は、井ノ口が米国コロンビア大学医学部のEric Kandel教授 (2000年ノーベル賞受賞者)の研究室での研究生活を終え、 1993年7月に帰国してから始まりました。その時の問題意識は「分子の窓から 記憶を覗いてやろう」でした。すなわち、長期間保存される記憶のメカニズムを 分子レベルから解き明かしたいというのが研究の動機でした。この問題意識は、 「分子と神経回路の窓から記憶を覗いてやろう」へと発展してきています。