研究内容
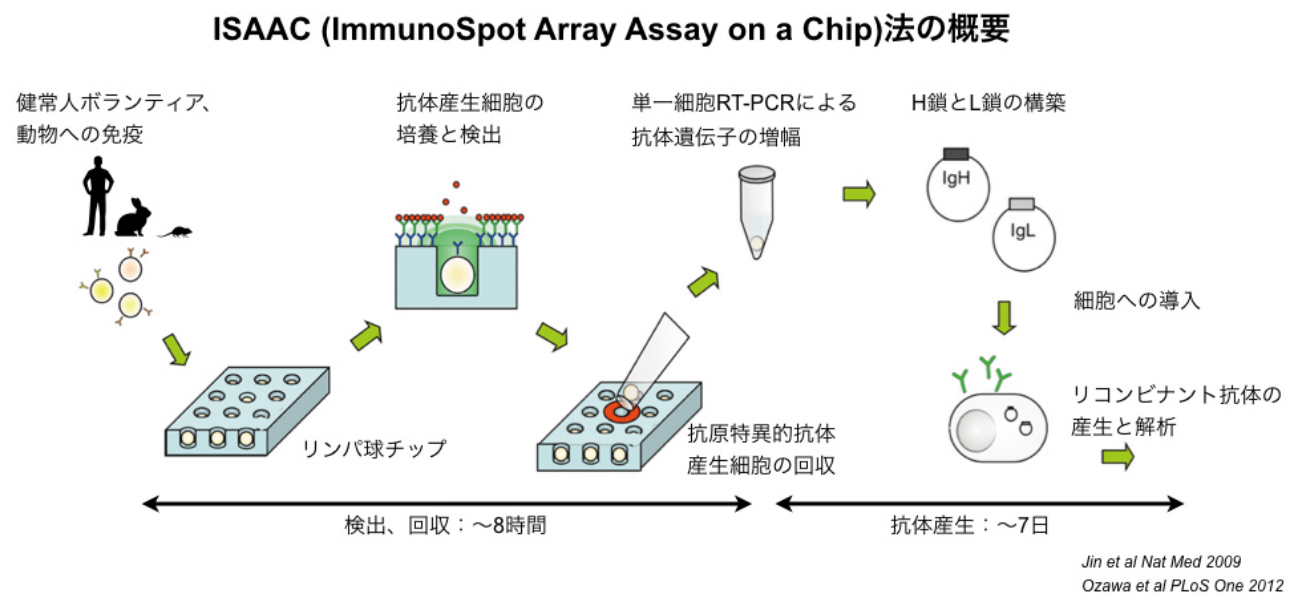
ISAAC(ImmunoSpot Array Assay on a Chip)法は、ヒトやマウス、ウサギのモノクローナル抗体が迅速に作製できる方法です。
B細胞が1個だけ入る穴(直径10〜15μm)が最大234,000個あるリンパ球チップを用いて、抗原特異的な抗体産生細胞を見つけ出します。そしてその細胞を回収して抗体遺伝子を単離して、リコンビナントモノクローナル抗体を1週間程度で作製することができます。
今までに、ウイルスに対して中和活性を持つヒト抗体、自己免疫疾患患者由来の自己抗体、膜タンパク質に対するウサギ抗体など、様々な抗原に対して、数多くの抗体を作製してきました。これらの抗体を用いて、ウイルス感染症の治療、自己免疫疾患発症メカニズムの解明、がん細胞を標的とした抗体医薬開発などの研究を行っています。
予防接種をすると、それに対する抗体が誘導されます。例えば冬場にインフルエンザの予防接種をしますが、それによってインフルエンザウイルスを中和する抗体を誘導させています。
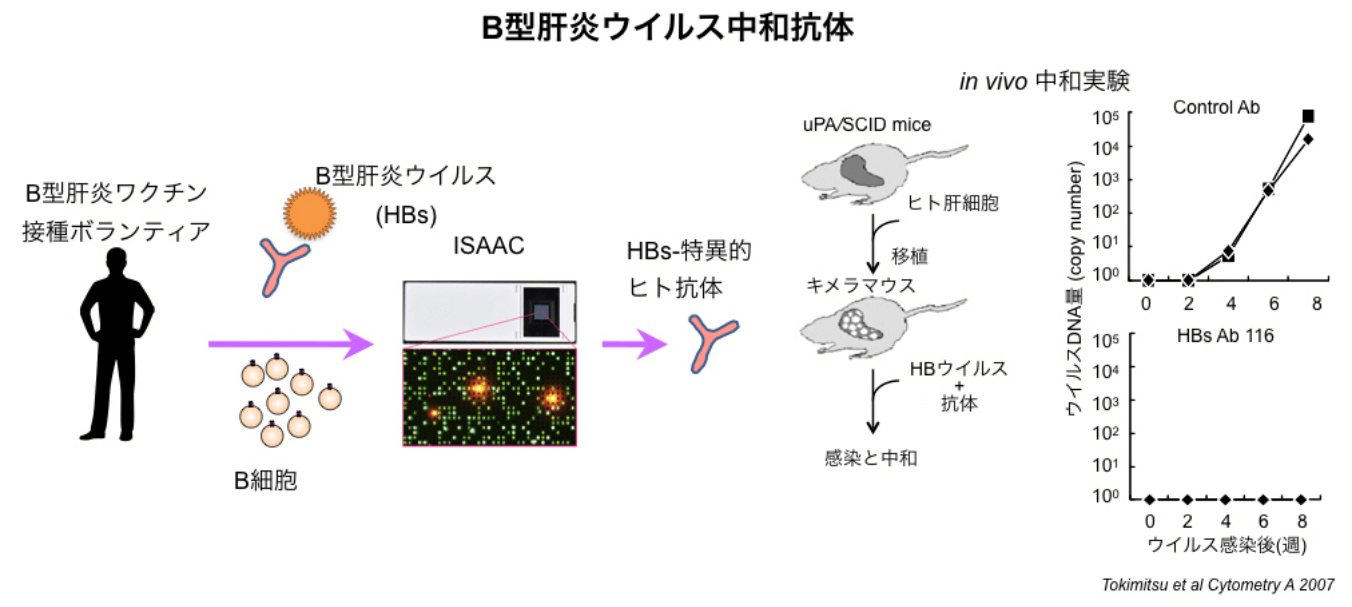
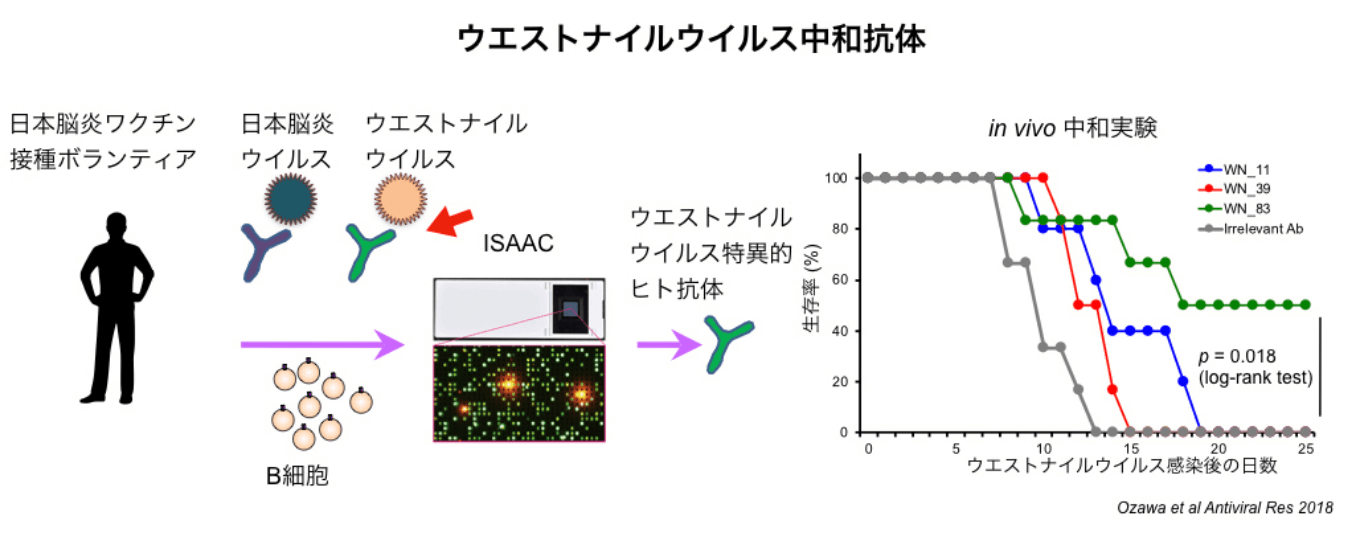
私たちは、ISAAC法を用いて、インフルエンザやB型肝炎ウイルスの予防接種したヒトから、インフルエンザウイルスやB型肝炎ウイルスを中和するモノクローナル抗体を作製しました。さらに、日本脳炎の予防接種をしたヒトから、日本脳炎ウイルスの近縁であるウエストナイルウイルスを中和するモノクローナル抗体を作製しました。
このようにISAAC法を用いることで、予防接種で抗体を誘導させた後に様々なウイルスを中和する抗体を得ることができたことから、ウイルス中和を目的とした抗体医薬開発への応用が期待されます。
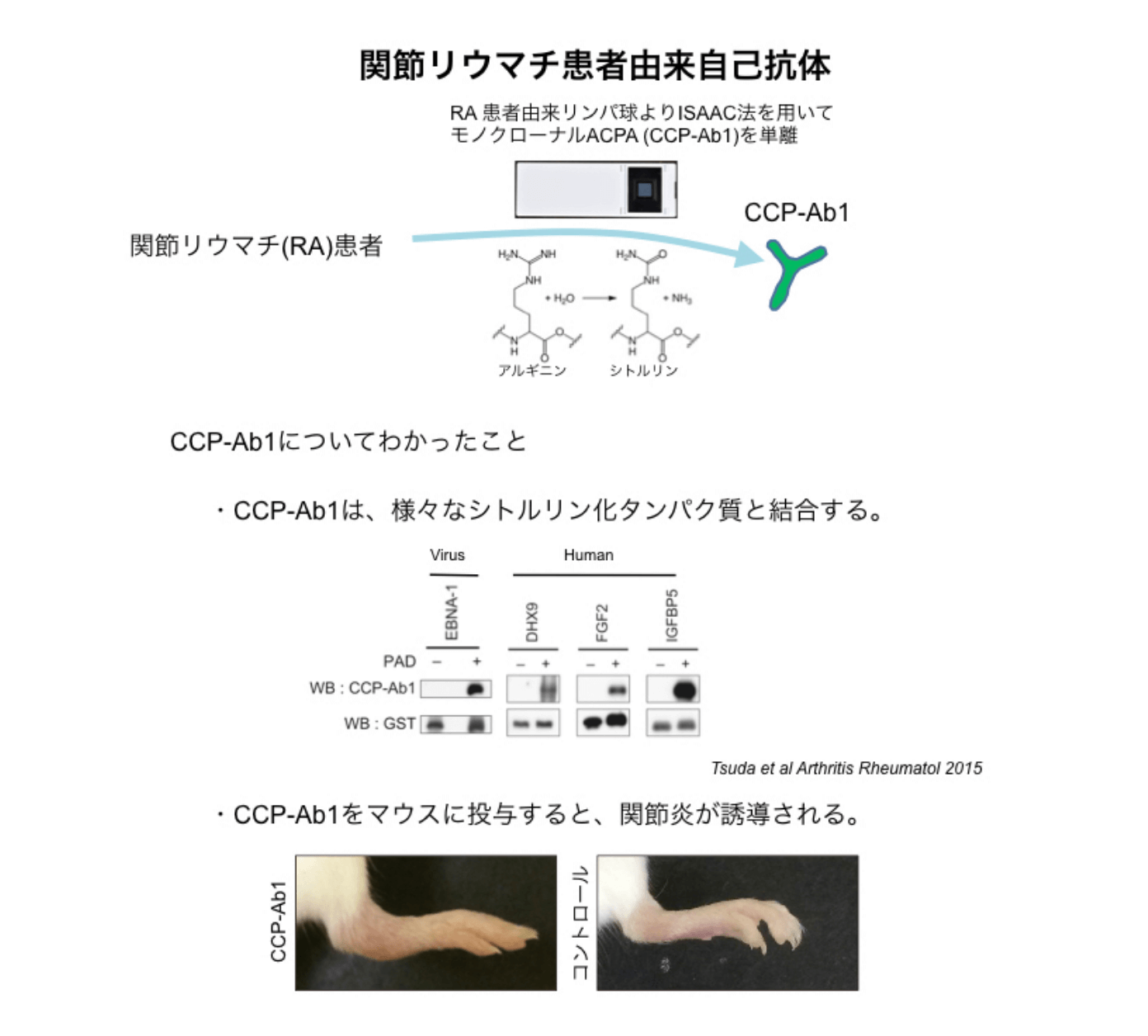
自己免疫疾患の1種である関節リウマチ(RA)では、その患者さんの殆どは、シトルリン化されたタンパク質に対する自己抗体(ACPA)が誘導されています。ACPAが、どのようにして誘導されるのか、ACPAがどのようなタンパク質と認識するのか、ACPAはRAの発症や進行に関与しているのか、今まで殆どわかっていませんでした。
私たちは、ISAAC法を用いて、RA患者さんのB細胞よりモノクローナルACPA、CCP-Ab1を単離しました。そしてCCP-Ab1とRAの関係について、様々な解析を行っています。その結果、私たちが単離したCCP-Ab1は、ヒト由来のシトルリン化されたタンパク質だけでなく、数多くの自然界に存在する細菌やウイルス由来のシトルリン化されたタンパク質と結合することが認められました。この結果より、自然界に存在するタンパク質がヒトのからだの中でシトルリン化され、そのシトルリン化タンパク質によってCCP-Ab1が誘導されることが示唆されました。さらに私たちが単離したCCP-Ab1をマウスに投与することで、実験的に関節炎を誘導したことから、CCP-Ab1は、RAの発症や進行に関与していることが示されました。
このように、自己免疫疾患の原因となる自己抗体を単離して解析することで、今まで明らかにされてなかった自己免疫疾患の原因の解明や、その機序を理解した新しい治療法の開発への応用が期待されます。
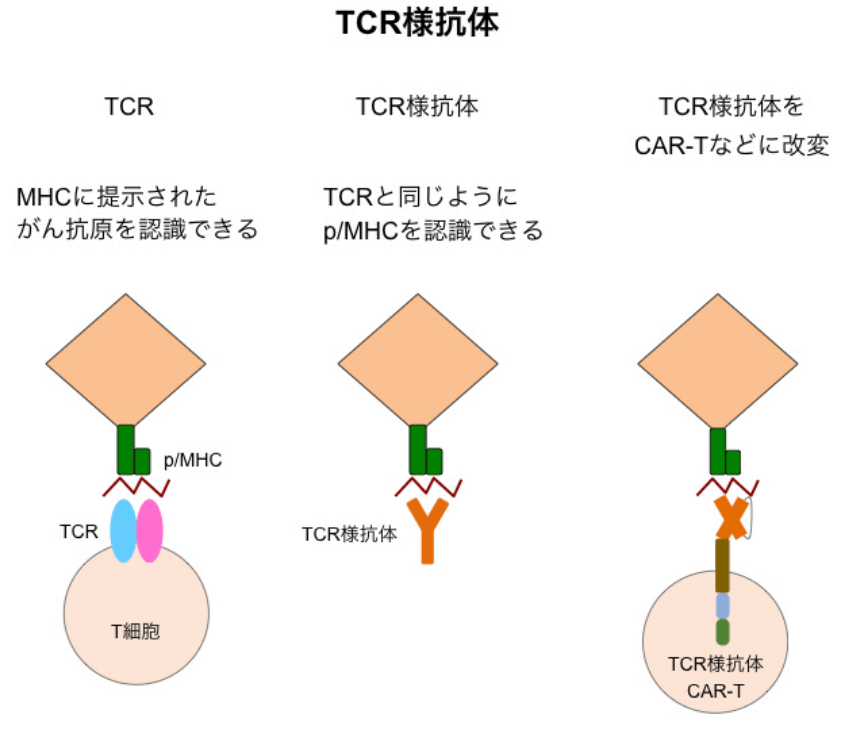
私たちは、がん治療を目的として、がん抗原ペプチド/MHCを認識するTCRの取得とその解析を行っています。同様に、がん抗原ペプチド/MHCを認識する抗体を取得とその解析も行っています。
TCRと同じように抗原ペプチド/MHCを認識する抗体は、TCR様抗体と呼ばれており、がん細胞を特異的に標的にできるツールとして研究が進んでいます。また、TCR様抗体を用いたCAR-Tなどへの応用の研究も進んでいます。しかしながら、様々な技術は発達した現在でもTCR様抗体の作製はとても難しく、TCR様抗体を用いてがん細胞を標的とした抗体医薬の開発は限定的でした。そこで私たちは、TCR様抗体の作製を効率良く行えるようISAAC法に改良を加えた方法を確立しました。
この方法で、幾つかのがん抗原ペプチド/MHCに対するTCR様抗体の取得に成功しました。現在、得られたTCR様抗体をCAR-Tなどに改変して、がん細胞を標的とした抗体医薬開発の研究を行っています。
T細胞受容体(TCR)は細胞内に発現する分子を認識できることから、細胞内に存在するがん分子を標的にすることが可能です。そこで、抗原特異的なTCRを用いたTCR-T療法が注目され、研究が行われていますが、あまり進展していません。とりわけ日本人に多いHLA型に対応したTCR-T細胞療法は開発が進んでいません。その主な理由としてTCRの結合力の弱さが考えられています。通常TCRの結合力は抗体に比べてずっと弱く、TCRを介してキラーT細胞を活性化することは簡単ではありません。
我々は1個1個のT細胞から10日間で効率よくTCR遺伝子を取得する技術の開発を行いました(図:hTEC10法)(Kobayashi et al. Nat Med 2013)。現在はhTEC10法を用いて、多数のがん患者のがん抗原特異的TCRの解析やウイルス抗原特異的TCR遺伝子の解析を行っています。
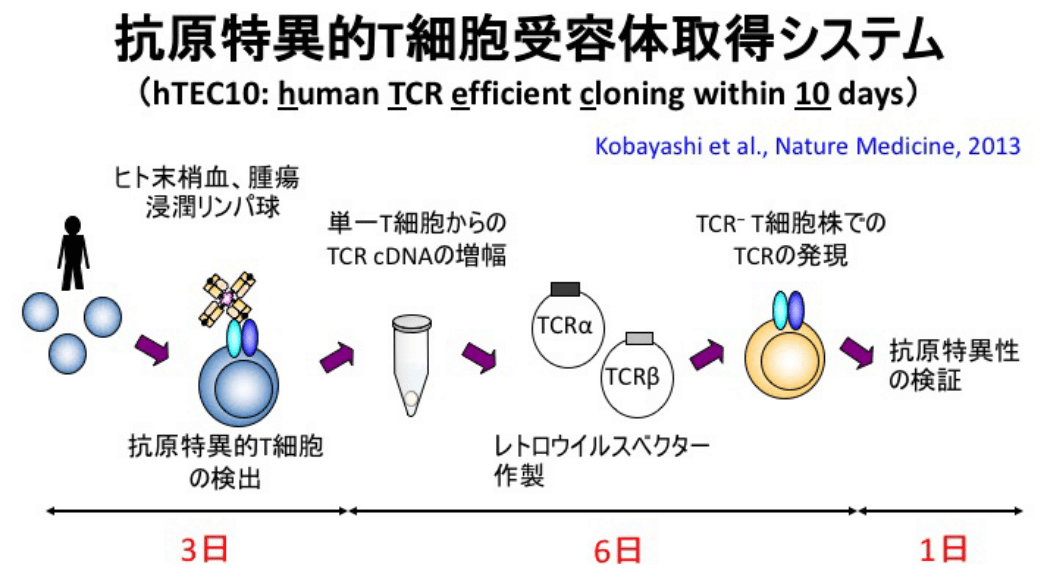
取得システムの概要ヒトの末梢血リンパ球やがん患者の腫瘍浸潤リンパ球からT細胞を単一細胞ソーティングし、TCR遺伝子を増幅させ、TCR発現ベクターを作製する。作製したTCR発現レトロウイルスベクターを用いて、TCR陰性のT細胞株にTCRを発現させ、特異性を評価する。これを10日間で行うことができる。
TCR-T細胞療法は、腫瘍特異的TCR遺伝子をT細胞へ遺伝子導入して作製したTCR-T細胞をがん患者に投与してがんを治療する治療法である。TCR-T細胞療法に用いる腫瘍特異的TCR遺伝子は、がん患者の腫瘍浸潤リンパ球や末梢血リンパ球などからクローニングされるが、大変な労力を必要とされ、より簡便な方法の開発が求められている。
富山大学免疫学では、培養細胞株を用いて少ない労力で腫瘍特異的TCR遺伝子をクローニングするシステムの開発を行っている。これまでに、HEK293T細胞を用いたルシフェラーゼレポーターアッセイ法でTCRの抗原反応性を簡便・迅速に解析するシステムを構築した(Hamana et al, 2016, BBRC, 下図)。現在は、このシステムを改良し、がん患者の腫瘍浸潤リンパ球から、がん抗原(オンコアンチゲンやネオアンチゲン)に特異的なTCR遺伝子をクローニングするシステムの開発を進めている。
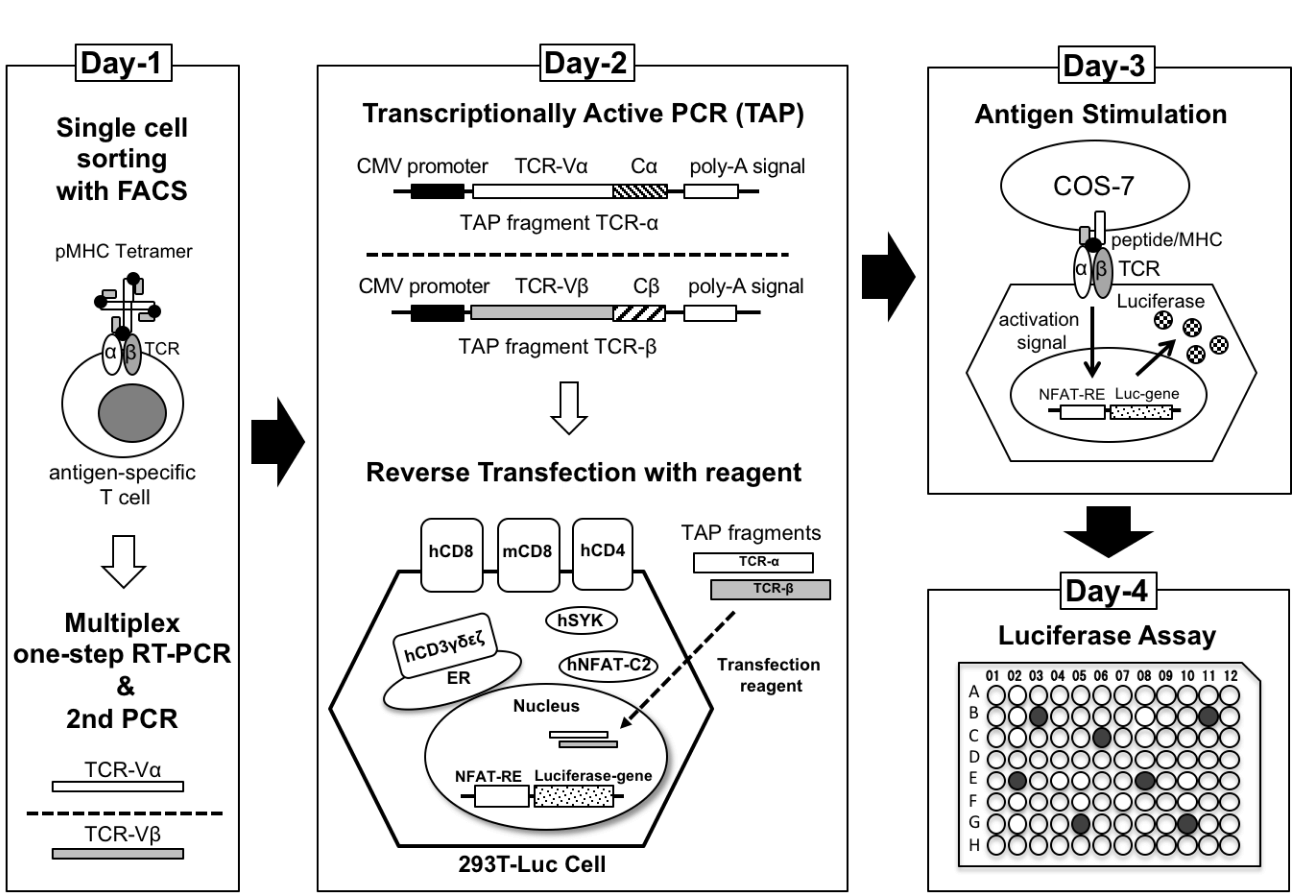
簡便・迅速に解析するシステム
キメラ抗原受容体(Chimeric antibody receptor: CAR)は、がん抗原に特異的なモノクローナル抗体可変領域の軽鎖と重鎖を直列に結合させた単鎖抗体(scFv)をN末端側に、T細胞受容体(TCR)のCD3ζ鎖をC末端側に持つキメラタンパクです。CARを発現させたT細胞はscFv領域でがん抗原を認識した後、その認識シグナルを細胞内のCD3ζドメインを通じてT細胞内に伝達することでT細胞が活性化します。さらに、T細胞の活性化を増強するために、scFvとCD3ζ鎖の間に共刺激分子(CD28または4-1BBの一方、あるいはその両者)を組み込まれたCARは第2世代、第3世代CARとよばれ、CAR-T細胞の細胞障害活性と増殖能が高いことが示されています(図)。
我々独自に開発した抗体遺伝子クローニングシステム(ISAAC法)を応用し、効果的なCAR-T療法の開発を目指した基礎的な研究を行っている(Kobayashi et al. BBRC 2014)。
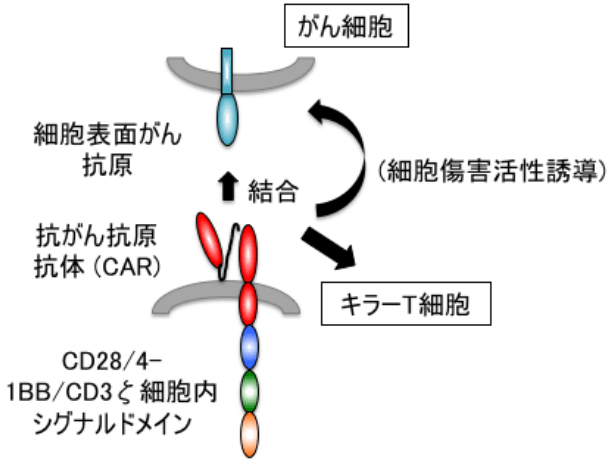
CAR導入キラーT細胞による
がん細胞傷害機構の模式図抗がん抗原抗体CARががん抗原に結合すると、キラーT細胞にシグナルが伝達されるため、キラーT細胞の細胞傷害活性が誘導される。
