1. TATEYAMA研究
― プレクリニカル関節リウマチの定義付けを目指した未病コホート構築と新規検査法開発 ―

関節リウマチ(Rheumatoid Arthritis; RA)は、関節滑膜を炎症の首座とする慢性炎症性疾患であり、進行すると関節破壊や生活機能の低下を引き起こします。近年の診断・治療法の進歩により、早期介入によって関節破壊の抑制が可能となってきましたが、薬剤の使い分けや、ドラックフリー寛解の達成が困難なことによる治療の長期安全性、医療経済的な問題が課題として残されています。この解決には、より早期、もしくは未発症の段階での介入が注目されています。
TATEYAMA研究は、RAの超早期・未病段階にある症例を特定し、その特徴を明らかにすることで、将来的なRAのさらなる早期治療や病態解明の礎となるデータを構築することを目的とした多施設共同前向き研究です。「リウマトイド因子(RF)もしくは抗環状化シトルリン化ペプチド(CCP)抗体が陽性、あるいは関節の症状を有するものの、RAの分類基準を満たさない成人」の方を対象に、実診療で得られる診察所見・血液検査・画像検査の情報を1年ごとに記録し活用させていただきます。 ※本研究は、国立研究開発法人日本医療研究開発機構(AMED)の支援を受けて実施されています。
2. 自己抗体研究
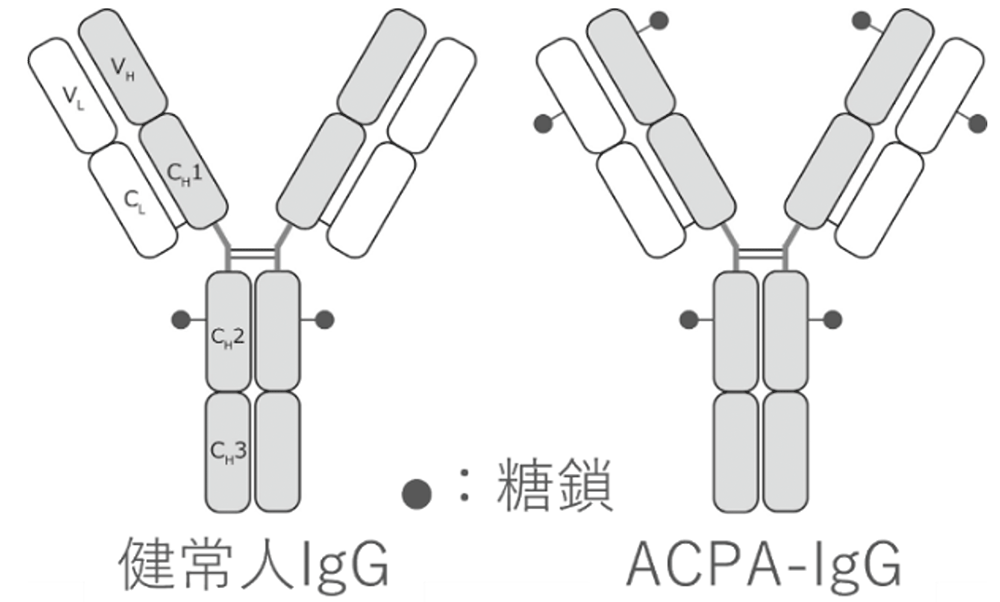 本学免疫学教室と共同し、自己免疫疾患患者由来B細胞を用いた研究を行っています。とりわけ、関節リウマチ(Rheumatoid Arthritis; RA)患者にみられる抗シトルリン化タンパク質抗体(Anti-Citrullinated Protein Antibodies; ACPA)の産生機序および病原性に注目しています。本学で樹立したRA患者由来モノクローナルACPA-IgG(CCP-Ab1)を用いた解析により、ACPAが自己抗原である血漿由来フィブリノーゲンに加え、ウイルス・真菌・細菌・食物など、種々の外来のシトルリン化抗原とも結合することが分かりました(Tsuda R Arthritis Rheumatol 2015)。
本学免疫学教室と共同し、自己免疫疾患患者由来B細胞を用いた研究を行っています。とりわけ、関節リウマチ(Rheumatoid Arthritis; RA)患者にみられる抗シトルリン化タンパク質抗体(Anti-Citrullinated Protein Antibodies; ACPA)の産生機序および病原性に注目しています。本学で樹立したRA患者由来モノクローナルACPA-IgG(CCP-Ab1)を用いた解析により、ACPAが自己抗原である血漿由来フィブリノーゲンに加え、ウイルス・真菌・細菌・食物など、種々の外来のシトルリン化抗原とも結合することが分かりました(Tsuda R Arthritis Rheumatol 2015)。
 また、RAのマウスモデルにCCP-Ab1を投与したところ、関節炎の増悪、破骨細胞数の増加、炎症性サイトカインIL-6の産生増強が認められました(Ozawa T Arthritis Rhumatol 2020)。さらには、ACPA-IgGの他のIgGとは異なる最大の特徴として、9割以上の可変領域にN-結合型糖鎖(以下、N-糖鎖)が含まれることが挙げられますが、本学で樹立したCCP-Ab1にも、可変領域に3カ所のN-糖鎖付加部位が存在していました。そこで、N-糖鎖が付加しないCCP-Ab1(CCP-Ab1 N-rev)を新たに作製し、比較実験を行った結果、CCP-Ab1 N-revはCCP-Ab1と同様に、血漿由来フィブリノーゲンをはじめ種々のシトルリン化タンパク質と結合した一方、関節炎の増強や破骨細胞分化の誘導といった病原性は示しませんでした。
また、RAのマウスモデルにCCP-Ab1を投与したところ、関節炎の増悪、破骨細胞数の増加、炎症性サイトカインIL-6の産生増強が認められました(Ozawa T Arthritis Rhumatol 2020)。さらには、ACPA-IgGの他のIgGとは異なる最大の特徴として、9割以上の可変領域にN-結合型糖鎖(以下、N-糖鎖)が含まれることが挙げられますが、本学で樹立したCCP-Ab1にも、可変領域に3カ所のN-糖鎖付加部位が存在していました。そこで、N-糖鎖が付加しないCCP-Ab1(CCP-Ab1 N-rev)を新たに作製し、比較実験を行った結果、CCP-Ab1 N-revはCCP-Ab1と同様に、血漿由来フィブリノーゲンをはじめ種々のシトルリン化タンパク質と結合した一方、関節炎の増強や破骨細胞分化の誘導といった病原性は示しませんでした。
以上から、ACPAの可変領域のN-糖鎖は、一般的なB細胞の生存や分化とは独立して、RAの病態に直接関わるという新しい機序を示しました(Kawataka M Rheumatology (Oxford) 2023)。本研究は、今後も創薬や新たな疾患活動性指標の開発といった臨床応用に繋げていく予定です。
3. 滑膜生検の臨床導入と研究への活用
 関節リウマチ(Rheumatoid Arthritis; RA) をはじめとする多くの関節炎疾患では、滑膜を中心として病態が形成されます。これまで滑膜組織の採取は技術的に困難とされ、実用的な価値は限定的と考えられてきました。
関節リウマチ(Rheumatoid Arthritis; RA) をはじめとする多くの関節炎疾患では、滑膜を中心として病態が形成されます。これまで滑膜組織の採取は技術的に困難とされ、実用的な価値は限定的と考えられてきました。
近年、欧州を中心に普及しつつある超音波ガイド下滑膜生検(Ultrasound-Guided Synovial Biopsy; UGSB)は、従来の方法と比較して低侵襲であり、安全性・忍容性に優れている点が特徴です。臨床的には、滑膜の病理組織検査によって、結核菌や真菌などによる感染性関節炎、腫瘍、結晶沈着症(痛風・偽痛風)などの鑑別診断が可能です。
また研究領域でも、滑膜のシングルセルRNAシーケンシングなどの先進的な手法によって、細胞レベルでRAの病因に対する理解が深まっています。日本国内でUGSBを行う施設はまだ限られています。滑膜にはT細胞、B細胞、単球・マクロファージ、滑膜線維芽細胞などの細胞が存在し、RAなどの自己免疫疾患で複雑に病態を形成しています。私たちは、滑膜中のT細胞の機能解析を行うことで、RAの病態をさらに解明し新たな治療法の開発につなげることを目指しています。