脂肪組織マクロファージの役割と代謝調節
私たちの研究室では、糖尿病や肥満などの代謝疾患の病態解明に向け、脂肪組織に存在する免疫細胞「マクロファージ」に注目した研究を行っています。従来、マクロファージは細菌やウイルスなどの病原体排除に関与する免疫細胞として認識されてきましたが、近年では、組織の恒常性維持や代謝調節においても重要な役割を果たすことが明らかになっています。
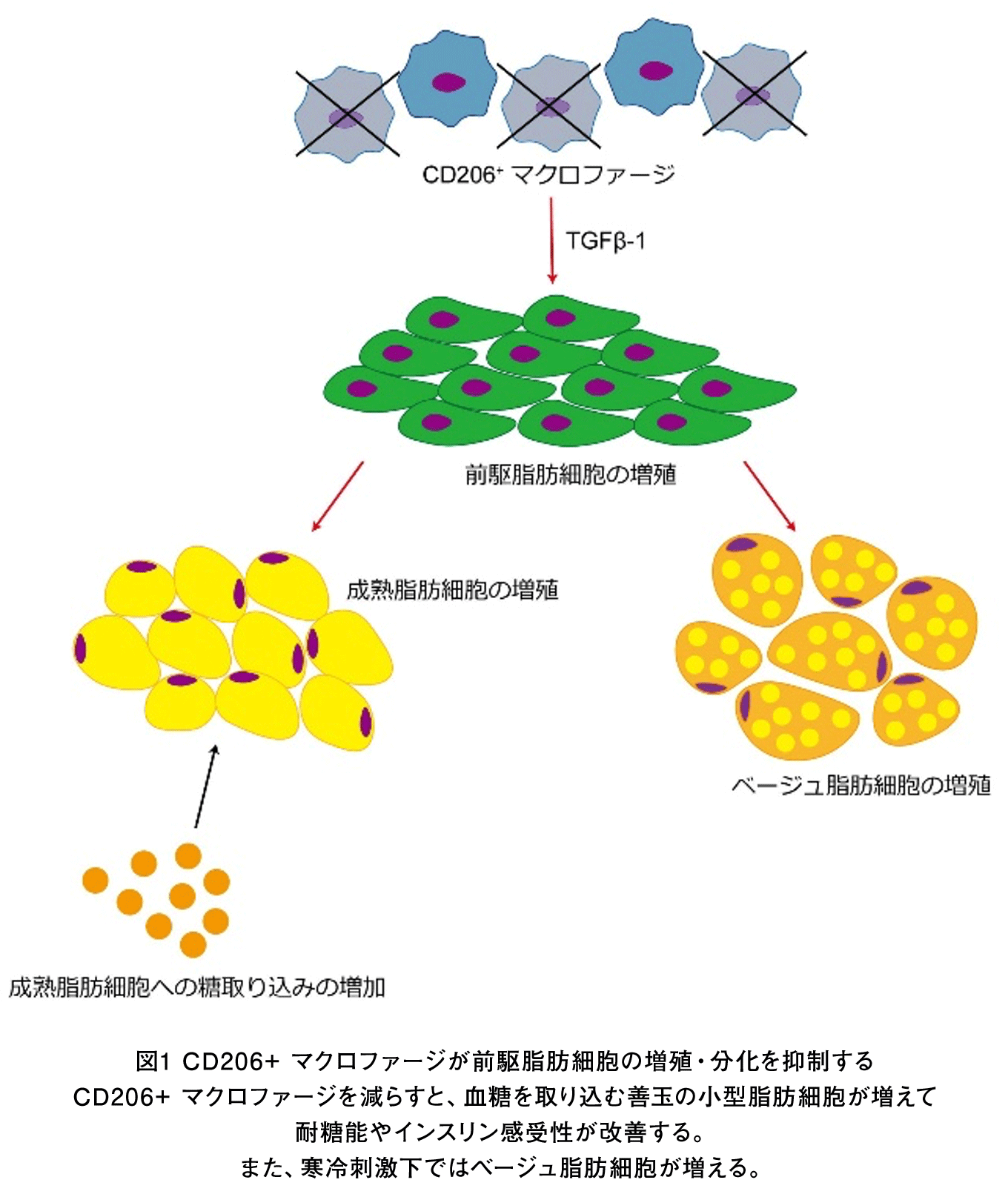 私たちは、特にCD206と呼ばれるマーカーを持つマクロファージに注目し、その機能を詳細に解析してきました。まず、脂肪組織のCD206⁺ マクロファージが、前駆脂肪細胞(adipocyte progenitors:AP)の増殖と分化を抑制することにより、脂肪組織の恒常性やインスリン感受性を調節していることを明らかにしました(Nawaz A. Nat Commun, 2017. 図1)。さらに、CD206⁺ マクロファージ由来のサイトカインTGF-β1が脂肪組織内の小型脂肪細胞の数を制御し、インスリン感受性の調節に寄与していることを明らかにしました(Phuong NQ. Sci Rep, 2025. 図1)。
私たちは、特にCD206と呼ばれるマーカーを持つマクロファージに注目し、その機能を詳細に解析してきました。まず、脂肪組織のCD206⁺ マクロファージが、前駆脂肪細胞(adipocyte progenitors:AP)の増殖と分化を抑制することにより、脂肪組織の恒常性やインスリン感受性を調節していることを明らかにしました(Nawaz A. Nat Commun, 2017. 図1)。さらに、CD206⁺ マクロファージ由来のサイトカインTGF-β1が脂肪組織内の小型脂肪細胞の数を制御し、インスリン感受性の調節に寄与していることを明らかにしました(Phuong NQ. Sci Rep, 2025. 図1)。
加えて、私たちは寒冷刺激下における脂肪細胞のベージュ化(白色脂肪細胞が熱産生を担う褐色脂肪細胞様の性質を獲得する現象)にも着目し、CD206⁺ マクロファージがベージュ脂肪細胞の形成を抑制する働きを持つことを明らかにしました(Igarashi Y. Sci Rep, 2018. 図1)。また、骨格筋損傷からの回復過程においてCD206⁺ マクロファージを除去することで、線維芽前駆脂肪細胞(FAPs)が活性化されてフォリスタチンという分泌因子を分泌するため、骨格筋の分化や再生が促進されることを明らかにしました(Nawaz A. Nat Commun, 2022)。これらの研究は、マクロファージが代謝調節や骨格筋再生を司る重要な細胞であることを示しています。
代謝疾患における腸内細菌叢の役割
腸内細菌叢が代謝疾患に深く関与していることが近年注目されています。私たちは、栄養素の種類(コーンスターチ、果糖、分岐鎖アミノ酸、大豆油、ラード)が腸内細菌の構成を変化させ、これが血中脂質やインスリン感受性に影響を与えることを、無菌マウスを用いた研究で明らかにしました(Watanabe Y. iScience, 2021. 図2)。特に、大豆油由来の腸内細菌叢は著しい耐糖能異常を引き起こし、腸内細菌が宿主代謝に及ぼす影響の大きさを示しました。
 さらに、特定の腸内細菌、特にAkkermansia muciniphila(A. muciniphila)が、抗肥満・抗糖尿病効果を持つことが知られており、私たちはこの細菌の増加を促す食品成分の探索も行ってきました。Dioscoreae rhizomaなどの生薬がA. muciniphilaの腸内定着を促進し、肥満改善や耐糖能改善に寄与することを示しました(Fujisaka S. Diabetol Int, 2024)。また、防風通聖散(Bofutsushosan)がA. muciniphilaを増加させ、腸管バリア機能を高め、炎症や耐糖能異常を抑えることを報告しました(Fujisaka S. Sci Rep, 2020)。加えて、ビールホップ由来のフラボノイドであるIsoxanthohumol(IX)が、A. muciniphilaの選択的増加を促しながら、膵リパーゼ阻害や脂質吸収の抑制を通じて肥満・脂肪肝を改善することも明らかにしました(Watanabe Y. Mol Metab, 2023)。
さらに、特定の腸内細菌、特にAkkermansia muciniphila(A. muciniphila)が、抗肥満・抗糖尿病効果を持つことが知られており、私たちはこの細菌の増加を促す食品成分の探索も行ってきました。Dioscoreae rhizomaなどの生薬がA. muciniphilaの腸内定着を促進し、肥満改善や耐糖能改善に寄与することを示しました(Fujisaka S. Diabetol Int, 2024)。また、防風通聖散(Bofutsushosan)がA. muciniphilaを増加させ、腸管バリア機能を高め、炎症や耐糖能異常を抑えることを報告しました(Fujisaka S. Sci Rep, 2020)。加えて、ビールホップ由来のフラボノイドであるIsoxanthohumol(IX)が、A. muciniphilaの選択的増加を促しながら、膵リパーゼ阻害や脂質吸収の抑制を通じて肥満・脂肪肝を改善することも明らかにしました(Watanabe Y. Mol Metab, 2023)。
これらの研究は、腸内細菌をターゲットとした機能性食品やプレバイオティクスの開発につながることが期待されます。
代謝疾患の理解と新たな治療標的の創出へ
私たちは、マクロファージや腸内細菌以外にも多角的な視点から代謝疾患の研究を行っています。高脂肪食によってCD8⁺ T細胞が機能低下し、がんの進行が促進されることを明らかにしました(Kado T. Sci Rep, 2019)。また、前駆脂肪細胞の部位別特性や可塑性の理解が重要と考え、研究を進めています。近年では、皮下脂肪組織には増殖能の高い前駆脂肪細胞が存在し、肥満時においても新たな脂肪細胞を形成する能力が保たれていることを示しました(Bilal M. Mol Metab, 2021)。
さらに、ヒトを対象とした臨床研究ではインスリン分泌指標であるC-peptide index(CPI)と2型糖尿病の臨床的特徴との関連や(J Diabetes Investig, 2024)、骨格筋量・サルコペニアとの関連を評価するコホート研究も進めており、基礎から臨床まで一貫した研究を通じて、代謝疾患の理解を深めています。
1型糖尿病に関しては、病態解明を目的とした多施設共同研究や、カーボカウントアプリの開発研究などに参加し主に臨床研究を行っています。最近では、代謝疾患における未病(健康な状態と病気の間にある、病気の一歩手前の状態)の病態解明を目指した研究にも取り組んでいます。このように私たちの研究室では、多様なアプローチで、糖尿病や肥満を中心とした代謝疾患の病態メカニズムを解明し、新たな予防・治療法の開発につなげることを目指しています。
第一内科、内分泌代謝疾患に興味のある医学生・医師の皆様へ
 内分泌代謝疾患の臨床能力を高めたい、基礎研究や臨床研究をやってみたい、ワークライフバランスを重視したいなど、個々の多様な価値観を尊重する風土が第一内科にはあります。
内分泌代謝疾患の臨床能力を高めたい、基礎研究や臨床研究をやってみたい、ワークライフバランスを重視したいなど、個々の多様な価値観を尊重する風土が第一内科にはあります。
安心して第一内科入局をご検討ください。もちろん、研究をやってみたい方は大歓迎です。
臨床医が研究をすることに意義を見出せない方もいらっしゃるかもしれませんが、一度は研究に身を投じてみることをお勧めします。内分泌代謝疾患を専門とする医師には論理的思考に基づいて、全身を診る力の醸成が求められます。研究を体験することで、より深く病態を考える思考が身につきます。特に難しい症例に出会ったときに病態から論理的に考えることで冷静に対応できるようになるはずです。
当科での研修や研究に少しでもご興味を持たれた方は、ぜひ一度見学にいらしてください。
未来の仲間にお会いできるのを心から楽しみにしています。