心不全グループ
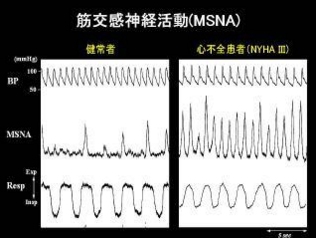 図1
図1図1は健常者と心不全患者より記録したMSNA(積分)波形、血圧、呼吸の同時記録である。健常者では4,5拍に1回程度の神経活動が見られるのに対し、重症心不全患者では全心拍に同期した神経活動が観察される。 このように交感神経活動の著しい亢進を可視化することができる。
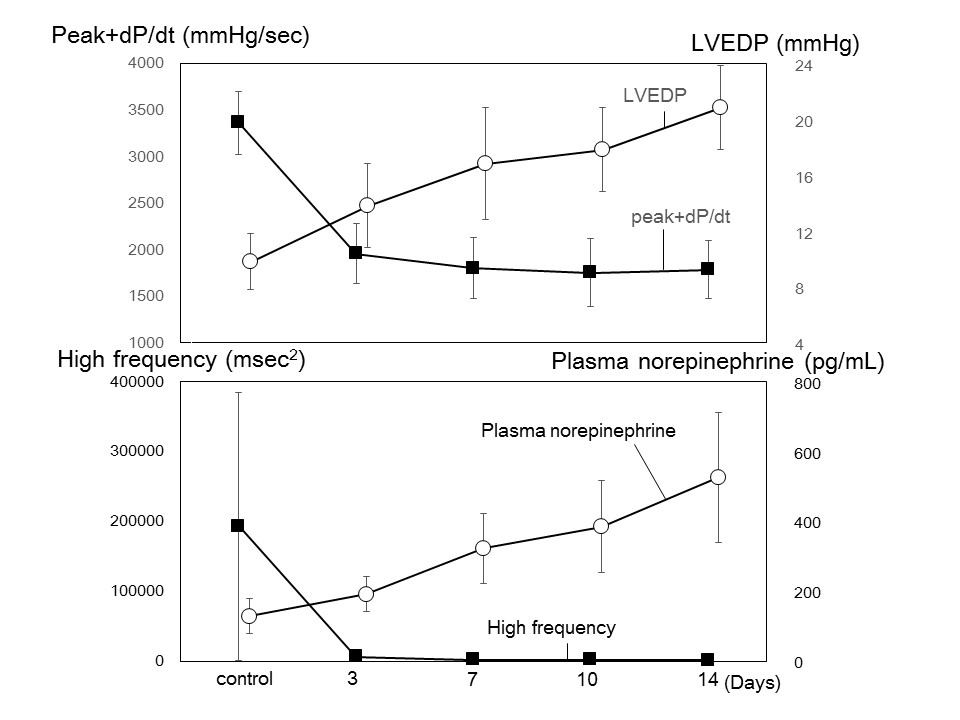 図2
図2一方、血漿ノルアドレナリン濃度でみた交感神経活動の活性化はdP/dtの変化とは一致せず、むしろ左室拡張末期圧の上昇に連動していることがわかる。事実、心機能・心拍出量低下、血圧低下の代償機転とは異なる交感神経活性化の機序が存在する。中枢からの交感神経活動に影響する因子には腎臓・肺を介する機序、骨格筋を介する機序(筋代謝受容器)、さらに睡眠時無呼吸による交感神経活動の亢進機序はいわば興奮性の刺激(excitatory stimuli)と称され、その一部はpara ventricular nucleusにおける中枢性の交感神経活動のセットポイントの上昇を介しホメオスターシスの維持に必要以上の交感神経反応を起こす。
最近、我々は拘束性呼吸機能障害が心不全における交感神経活動の亢進と密接に関係することを示した(Joho et al. J Card fail 2017)。この結果は肺を介する交感神経活動活性化機序について補強する意味を持ち、Journal of Cardiac failure(アメリカ心不全学会誌)のeditorialでも取り上げられた。 以上のように、心不全の進展に伴い、不全心を取り巻く諸臓器との神経体液性調節的な関わりの中で交感神経系は徐々に活性化され、心不全をさらに悪化させる悪循環を形成すると考えられる。
左室駆出率(LVEF)の低下した慢性心不全患者を対象とした臨床試験においてβ遮断薬はLVEFを改善するとともに心不全再入院と死亡率を減少させ、さらにその効果は用量依存性を示した。また先述のように慢性心不全患者では交感神経活動が亢進しており、その指標である血漿ノルエピネフリンレベルや筋交感神経活動(MSNA)のレベルいずれも独立した予後予測因子である。しかし心筋への交感神経活動の影響は、β遮断薬の用量、あるいは中枢からの交感神経のドライブの強さそれぞれ単独で決まるものではなく、両方の影響をうけるはずである。しかしこれまでに中枢からの交感神経活動のドライブとβ遮断薬の用量の両者を同時に考慮した検討はない。
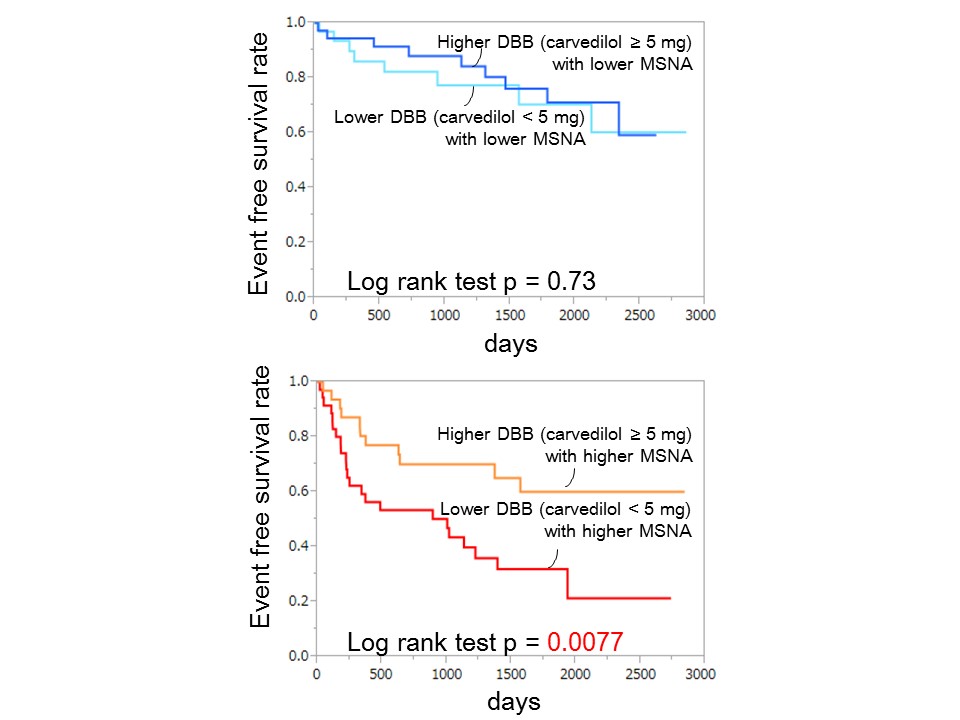 図3
図3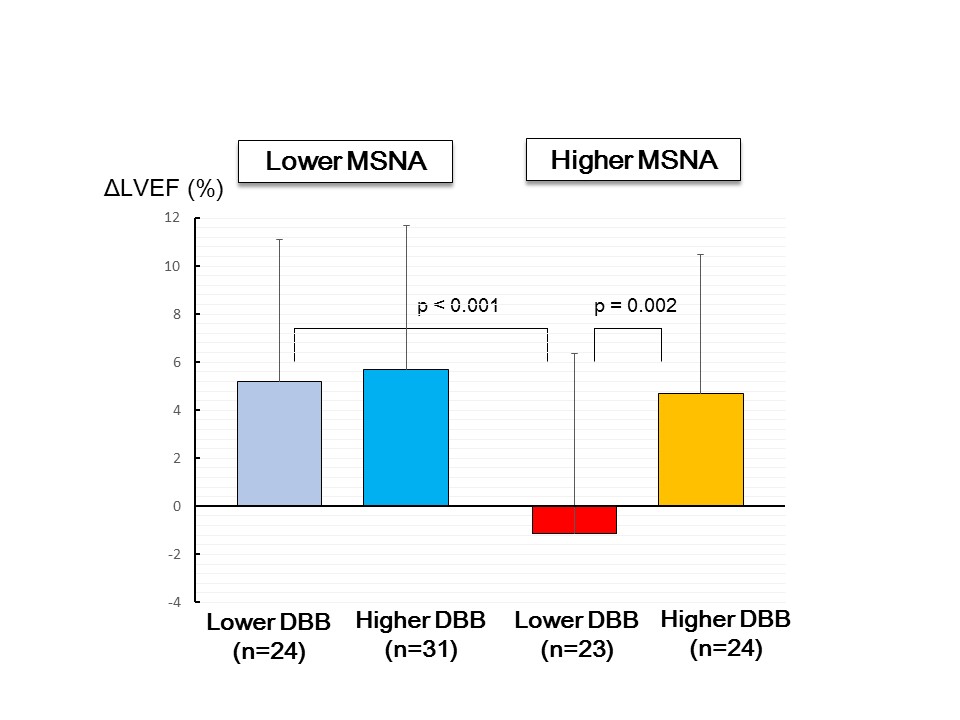 図4
図4以上より、高用量β遮断薬投与の予後へのインパクトはMSNAのレベルで異なり、MSNA亢進例で明確であることが示唆された。
 図5
図5交感神経活動を抑制するβ遮断薬は近年の心不全薬物療法において不可欠な存在であるが、β遮断薬を含めた標準的治療でも体動時の息切れなどの自覚症状や心機能が改善しない患者は少なくない。心不全患者でよく観察される呼吸のゆらぎは循環時間の延長と炭酸ガス化学感受性の亢進のため惹起される。炭酸ガス化学感受性の亢進は交感神経活動との関連が示唆される一方、呼吸のゆらぎ自体は交感神経活動に影響する。 呼吸補助療法として慢性心不全患者を中心に臨床で使用されているadaptive servo ventilation (ASV)は、治療機器が患者の呼吸パターンを逐次モニタリングし、一回換気量をほぼ一様にすることができる。
私たちはこれまでASVに関する以下の点を解明してきた。
(1)ASVによる呼吸正常化に伴い、慢性心不全患者の交感神経活動が抑制される(Harada, Joho, et al. Auton Neurosci 2011)。
(2)ASV夜間長期使用による呼吸の改善効果が心機能の改善・交感神経活動の抑制と関係する(Joho, et al. J Card Fail 2012)。
(3)呼吸の改善効果は運動時周期性呼吸、換気応答の改善と関連する(Joho, et al. Int J Cardiol ME 2013)。
(4)ASVの交感神経活動抑制効果はCPAPでは観察できない(ASVのサーボベンチレーションの機能が交感神経活動改善と関連している)(Ushijima, Joho, et al. Circ J 2014)。
以上の結果は、ASVが慢性心不全患者の中でも特に呼吸のゆらぎが顕著な患者において有用であることを示唆している。
以上、β遮断薬とASV療法は交感神経系に異なるレベルで作用し、心不全病態の改善に効果的に働く可能性がある。上流からの交感神経のドライブの強さを念頭に置き、それに見合うβ遮断薬の用量設定と上流への介入を行うことにより、重症心不全を改善させる糸口になると考える。


